Mới đây, Cục Quản lý Dược vừa ban hành công văn số 1729 gửi Sở Y tế các tỉnh, thành phố về các loại thuốc giả, thuốc không rõ nguồn gốc xuất xứ.
Theo đó, Cục Quản lý Dược nhận được một số thông tin của Cơ quan Cảnh sát điều tra - Công an huyện Thạch Thất; Công ty TNHH AstraZeneca Việt Nam; Công ty TNHH Novartis Việt Nam; Văn phòng đại diện F.Hoffmann-La Roche Ltd tại Hà Nội, Văn phòng đại diện Les Kaboratoires Servier tại Hà Nội về việc phát hiện một số lô thuốc nghi ngờ giả, không rõ nguồn gốc có thông tin ghi trên nhãn. Cụ thể:
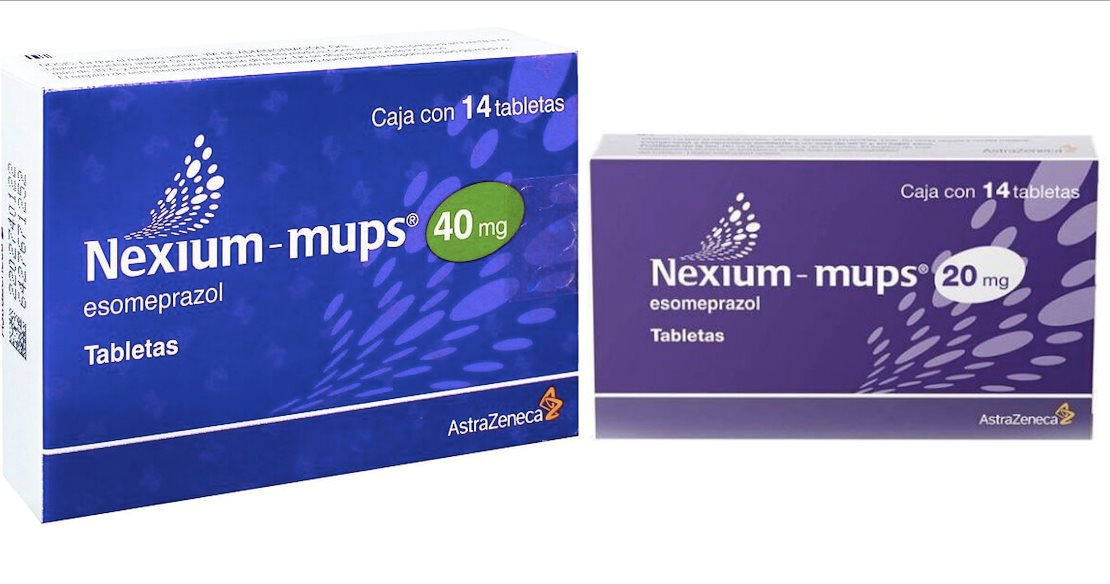
Thuốc Nexium 40mg, Enterik Kapli Pellet Tablet, AstraZeneca, (01) 08699786040045, (21) 3500000157639358; (17) SKT: 09.2024; (10) Parti no: 22B264.
Nexium 40mg, Enterik Kapli Pellet Tablet, AstraZeneca, Số lô: 21H979, mỗi hộp có 4 vỉ, mỗi vỉ 7 viên.
Tiếp đến là Tetracyclin Tw3 250mg, SĐK: VD-28109-17, Số lô SX: 0321, NSX: 02/02/2021, HD: 02/02/2024, Nhà sản xuất: Công ty Cổ phần dược phẩm Trung ương 3, qui cách hộp 400 viên nén.
Clorocid Tw3 250mg, SĐK: VD-25305-16, Số lô SX: 0321, NSX: 07/07/2021, HD: 07/07/2024, Nhà sản xuất: Công ty Cổ phần dược phẩm Trung ương 3, qui cách hộp 400 viên nén. Công ty CP Dược phẩm Trung ương 3 thông báo tới Cục Quản lý Dược từ 16/09/2019 đến 29/6/2022 tính từ thời điểm Công ty thông báo, đơn vị này không tiến hành sản xuất lô thuốc nào đối với Clorocid Tw3, SĐK: VD-25305-16.
Ngoài ra còn có TobraDex, hộp 1 lọ đếm giọt Droptainer 5ml, số lô: 22C10HB, ngày hết hạn/EXP: 10/03/2024, ngày sản xuất/ MFD: 10/03/2022.
Các loại thuốc đáng lưu ý còn bao gồm: Tecentriq 1200mg/20ml (atezolizumab), số lô B0033B03, HSD: 02/09/24, code 10001437939658;
Diamicron MR 30mg, số lô: 695986, HSD: 09/2024; và Coveram 5mg/5mg, số lô: 2170310010, HSD: 11/2024.
Với mục tiêu đảm bảo an toàn cho người sử dụng và đảm bảo tuân thủ chặt chẽ quy định của pháp luật trong sản xuất dược phẩm, Cục Quản lý Dược đã tiến hành đề nghị Sở Y tế các tỉnh, thành phố trực thuộc Trung ương kết hợp với các cơ quan Y tế các ngành, thông báo cho các cơ sở không kinh doanh, phân phối và sử dụng các sản phẩm có các đặc điểm đã nêu trên.
Tăng cường thanh tra, thực hiện kiểm soát các cơ sở kinh doanh dược trên địa bàn và kiểm tra công tác sản xuất sản phẩm thuốc có đặc điểm trên.
Để đảm bảo xử lý tận gốc vấn đề thuốc giả không rõ xuất xứ này, Cục Quản lý Dược đã yêu cầu sở Y tế các tỉnh nêu trên báo cáo lên Ban chỉ đạo 389 tỉnh, thành phố và hợp tác cùng cơ quan chức năng, kiểm tra xác định minh, truy tìm nguồn gốc xuất xứ của các sản phẩm trên.
Đối với các công ty sản xuất, kinh doanh, nhập khẩu, phân phối liên quan đến các sản phẩm thuốc có đặc điểm mô tô như trên, Cục Quản lý Dược yêu cầu phải phối hợp cung cấp mọi thông tin cần thiết với Sở Y tế các tỉnh, thành phố, các cơ quan chức năng trong quá trình truy tìm nguồn gốc xuất xứ của các sản phẩm này.







.jpg)
.png)